据不完全统计,今年上半年有39款新药在我国获批上市(不含中药与疫苗类产品),其中包括23款首次获批的新药,以及16款获批新适应症的产品。随着国家药品监督管理局优先审评审批制度的实施,不少产品审评审批速度加快,与上年同期相比,临床急需境外新药获批数量有所增加。
生物药领域迎来首款ADC药物
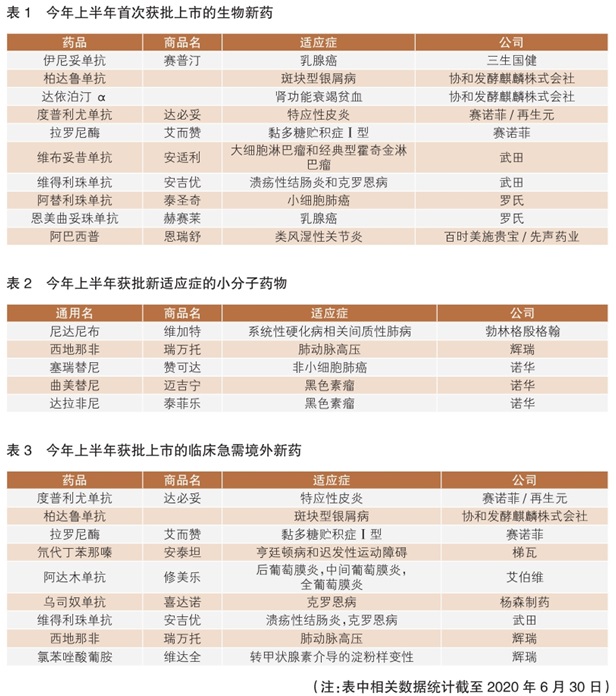
在今年上半年批准的39款新药中,21款为生物制剂(包括16款抗体药物),18款为小分子化药。按首次批准计算,上半年批准了10款生物药,多为进口产品。武田、罗氏、赛诺菲和协和发酵麒麟株式会社各有2款生物药获批(详见表1)。
近年来,不少新药研发公司持续投入生物药开发,创新产品相继获批上市,来自全球大型医药企业的创新生物药产品为我国患者带来更多治疗选择。
值得一提的是,今年1月我国首次批准了抗体偶联药物(ADC)恩美曲妥珠单抗上市——单药用于HER2阳性早期乳腺癌患者的辅助治疗。4个月后,国家药监局批准了第二款ADC药物维布妥昔单抗,用于大细胞淋巴瘤(sALCL)和霍奇金淋巴瘤(cHL)的治疗。
事实上,ADC药物开发并非一帆风顺。过去几十年中,业界投入大量资源和精力改进构建ADC技术,有效提高了ADC药物的获益/风险比。目前,全球已有8款ADC药物获批上市。此次国家药监局批准恩美曲妥珠单抗和维布妥昔单抗上市,意味着ADC这种创新疗法已在我国落地。
修美乐、PD-1“丰收”新适应症
每一款药物的成功获批都是科学家多年努力的成果,来之不易。如果它能扩展更多适应症,则意味着将有机会造福更多患者。
从今年上半年我国药品审评审批情况来看,至少有16款创新药产品获得了新适应症批准,其中5款为小分子化药获批新适应症。如诺华的黑色素瘤联合疗法曲美替尼和达拉非尼、入局ALK阳性局部晚期或转移性非小细胞肺癌一线治疗的塞瑞替尼,以及勃林格殷格翰获批系统性硬化病相关间质性肺病(SSc-ILD)治疗的尼达尼布。此外,还有辉瑞的西地那非获批新适应症——治疗肺动脉高压(详见表2)。
上半年,多款生物药在我国成功拓展新适应症。其中,艾伯维的全人源抗肿瘤坏死因子(TNFi)单克隆抗体阿达木单抗(修美乐)获批新适应症较多。作为艾伯维旗下重磅产品,该药自2010年首次在我国获批用于类风湿关节炎治疗以来,已相继获批7项适应症——今年1月份获批用于中重度活动性成人克罗恩病治疗;3月份获批用于非感染性中间葡萄膜炎、后葡萄膜炎和全葡萄膜炎治疗,该适应症曾被纳入临床急需境外新药名单;同月获批用于儿童斑块状银屑病(pPs)和多关节型幼年特发性关节炎(pJIA)治疗。
此外,备受瞩目的PD-1抗体斩获更多适应症。PD-1抗体等免疫检查点抑制剂,通过与相应配体结合,消除对T细胞活性的抑制,从而提高T细胞杀伤肿瘤的能力。这类疗法问世后,已被用于治疗多种癌症,并有望扩展至更多实体瘤和血液瘤的治疗。
在我国,首个PD-1抗体获批至今已有两年时间。此间,相关企业努力为其布局更多新适应症。上半年,PD-1抗体领域有6项新适应症获得批准。其中,恒瑞医药研发的卡瑞利珠单抗(艾瑞卡)收获颇丰,该药物先是在3月份获批用于晚期肝细胞癌治疗,成为我国企业研发的首个获批肝癌适应症的PD-1抑制剂。随后,在6月份又一举拿下肺癌、食管癌领域两个适应症。加上首个获批的复发或难治性经典型霍奇金淋巴瘤适应症,目前卡瑞利珠单抗共获批4大适应症。
此外,百济神州的替雷利珠单抗则通过优先审评获得第二项适应症——尿路上皮癌,其另外3个适应症也已提交上市申请;百时美施贵宝的Opdivo获得了第三项适应症——胃或胃食管连接部腺癌;默沙东的Keytruda获得第五项适应症——二线治疗食管癌。
除以上品种外,还有安进的地舒单抗、诺华的司库奇尤单抗、杨森的乌司奴单抗、德国默克的西妥昔单抗、礼来的度拉糖肽、诺和诺德的利拉鲁肽等多款生物药斩获新适应症。
9款临床急需境外新药获批
临床急需境外新药名单的公布及优先审评审批制度的实施,加快了一些针对罕见病、严重危及生命或严重影响生活质量的疾病治疗药物在我国上市速度。据不完全统计,自临床急需境外上市药品目录发布至今,国家药监局已批准36个品种进口注册。其中包括今年上半年批准的9款(详见表3),与上年同期相比,批准数量有所增长。往年获批情况显示,一般情况下下半年获批数量均超过10款,预计今年全年将会有更多临床急需境外新药在我国获批上市。
值得一提的是,辉瑞普强旗下枸橼酸西地那非片上市申请2019年9月获国家药监局药品审评中心(CDE)受理,2020年2月即通过优先审评获批上市,历时仅4个半月,成为在我国首个被批准用于治疗肺动脉高压的5型磷酸二酯酶(PDE-5)抑制剂,当属临床急需境外新药在我国成功获得加速批准的典型范例。
在这些获批的临床急需境外新药中,有多款“首个”值得关注。赛诺菲近日获批的重磅抗炎疗法度普利尤单抗注射液,是全球首个也是唯一获批治疗成人中重度特应性皮炎的靶向生物制剂;注射用拉罗尼酶浓溶液是全球首个、目前唯一获准治疗黏多糖贮积症Ⅰ型(MPSⅠ)的酶替代疗法,同时也是我国唯一治疗MPSⅠ的特异性治疗药物。梯瓦公司用于治疗与亨廷顿病(HD)有关的舞蹈病及成人迟发性运动障碍(TD)的创新药物氘代丁苯那嗪片,则是国家药监局和美国FDA批准的第一个氘代产品。
本土创新药企业成绩喜人
在39款获批新药中,有9款产品属于我国本土创新企业,其中7款为首次获批。它们是百济神州的BTK抑制剂泽布替尼、北海康成的HER2阳性乳腺癌药物奈拉替尼、豪森药业的非小细胞肺癌治疗药物阿美替尼、凯因科技的丙型肝炎药物盐酸可洛派韦胶囊、银谷制药的过敏性鼻炎药物苯环喹溴铵鼻喷雾剂、复星医药首个引进的血小板减少症新药阿伐曲泊帕、三生国健药业乳腺癌新药伊尼妥单抗。其中,北海康成的奈拉替尼和复星医药的阿伐曲泊帕均为从海外引进的产品。
百济神州泽布替尼的获批备受关注。该品于今年6月在我国通过优先审评审批程序附条件批准上市,首次获批两项适应症,包括套细胞淋巴瘤(MCL)和慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)。此外,它还是首个获得美国FDA授予“快速通道”“加速审评”“突破性疗法”和“优先审评”四大特殊通道资格认定的中国自主研发抗癌新药,去年11月率先在美国获批。
此外,凯因科技开发的国产1类新药盐酸可洛派韦胶囊,通过抑制NS5A蛋白而阻断HCV病毒的复制和组装,于今年2月在我国获批用于治疗成人慢性丙型肝炎病毒(HCV)感染。(药明康德供稿)
