据不完全统计,2020年上半年有39款新药在中国获批上市(不含中药与疫苗类产品),其中包括23款首次获批的新药,以及16款获得新适应证的产品。得益于国家药监局优先审评审批制度的实施,不少产品的审评审批速度加快,临床急需境外新药的获批数量同比去年也有所提高。本文将和大家一起看看上半年在中国获批新药的几大亮点。
生物药获批迎丰收——迎来首款ADC
在今年上半年批准的39款新药里,21款为生物制剂(包括16款抗体药物),小分子化药为18款。按首次批准计算,上半年批准了10款生物药,多为进口产品,其中武田(Takeda)、罗氏(Roche)、赛诺菲(Sanofi)和协和发酵麒麟株式会社各有2款。
近年来,随着不少新药研发公司在生物药开发方面的持续投入,创新产品已相继获批。来自全球大型医药公司的创新生物药产品,为中国患者带来了更多治疗选择。
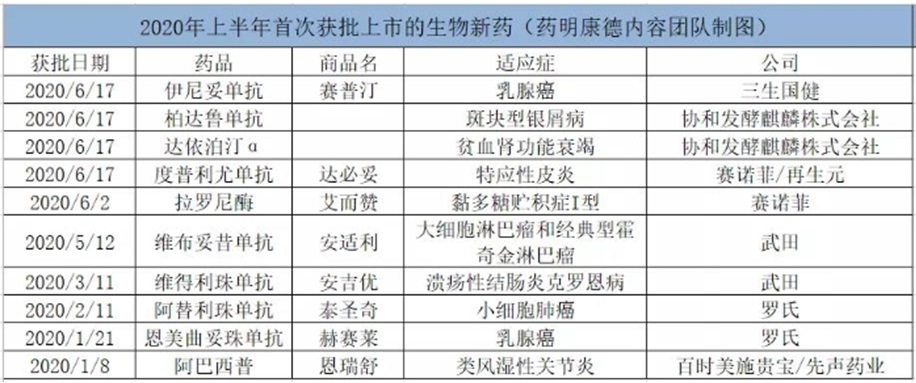
图1 注:数据截至2020年6月30日,以国家药监局批准日期为准。
值得一提的是,今年1月中国首次迎来了抗体偶联药物(ADC)恩美曲妥珠单抗,被批准单药用于HER2阳性早期乳腺癌患者的辅助治疗。4个月后,国家药监局批准了第二款ADC维布妥昔单抗,用于大细胞淋巴瘤(sALCL)和霍奇金淋巴瘤(cHL)的治疗。
ADC药物的开发并非一帆风顺,过去几十年业界投入大量资源和精力改进构建ADC技术,有效提高了ADC药物的获益/风险比。目前,全球已有8款ADC药物获批上市。此次恩美曲妥珠单抗和维布妥昔单抗在中国获批,对于中国生物制药行业而言也是一次新的进展,意味着ADC这种创新疗法已在中国实现落地。
拓展新适应证——修美乐、PD-1抗体领跑
每一款药物的成功获批都是科学家多年研发的成果,来之不易。如果它能扩展更多适应证,意味着它将有机会造福更多患者。
从今年上半年药品审评情况来看,至少有16款创新药产品获得了新适应证批准。其中5款为小分子化药获批新适应证,如诺华(Novartis)的黑色素瘤联合疗法曲美替尼和达拉非尼,入局ALK阳性局部晚期或转移性非小细胞肺癌患者一线治疗的塞瑞替尼,以及勃林格殷格翰(BoehringerIngelheim)获批系统性硬化病相关间质性肺病(SSc-ILD)的尼达尼布。此外,还有辉瑞的西地那非获批新适应证治疗肺动脉高压。
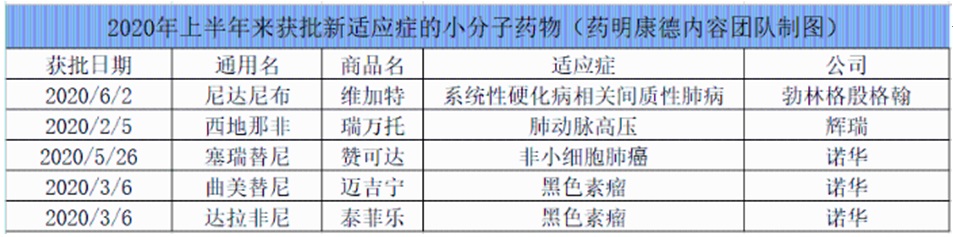
图2 注:数据截至2020年6月30日,以国家药监局批准日期为准
从生物药来看,上半年多款生物药取得了新适应证的成功拓展。其中艾伯维(AbbVie)的全人源抗肿瘤坏死因子(TNFi)单克隆抗体阿达木单抗(修美乐)收获新适应证较多。它是艾伯维旗下重磅产品,自2010年首次在中国获批用于类风湿关节炎以来,已相继获批7项适应证。其中,今年1月获批用于中重度活动性成人克罗恩病;3月获批用于非感染性中间葡萄膜炎、后葡萄膜炎和全葡萄膜炎患者,该适应证曾被纳入临床急需境外新药名单;同月获批用于儿童斑块状银屑病(pPs)和多关节型幼年特发性关节炎(pJIA)。
另一大亮点在于,备受瞩目的PD-1抗体迎来了更多适应证的获批。PD-1抗体等免疫检查点抑制剂,通过与相应配体结合,来消除对T细胞活性的抑制,从而提高T细胞杀伤肿瘤的能力。这类疗法问世以来已被用于治疗多种癌症,并有望扩展至更多实体瘤和血液瘤。
在中国,距离首个PD-1抗体获批已有2年,与此同时,它们正在布局更多新适应证。具体的,PD-1抗体领域2020上半年有6项新适应证获得批准。其中,恒瑞医药研发的卡瑞利珠单抗(艾瑞卡)收获颇多。该药物先是在3月获批晚期肝细胞癌,成为中国首个获批肝癌适应证的PD-1抑制剂,后在6月一举拿下肺癌、食管癌领域两个适应证。加上首个获批的复发或难治性经典型霍奇金淋巴瘤适应证,卡瑞利珠单抗目前共获批4大适应证。
另外,百济神州的替雷利珠单抗通过优先审评获得第二项适应证尿路上皮癌,另外三个适应证也均已提交上市申请;百时美施贵宝(BMS)的Opdivo获得了第三项适应证胃或胃食管连接部腺癌;默沙东(MSD)的Keytruda获得第五项适应证——二线治疗食管癌。
除了以上,还有安进(Amgen)旗下的地舒单抗、诺华旗下的司库奇尤单抗、杨森(Janssen)的乌司奴单抗、德国默克(MerckKGaA)旗下的西妥昔单抗、礼来的度拉糖肽、诺和诺德的利拉鲁肽等多款生物药斩获了新适应证,这里不再一一列举。
临床急需境外新药有望创新高——半年批9款
临床急需境外新药名单的公布及优先审评审批制度的实施,加快了一些对罕见病,严重危及生命或严重影响生活质量的疾病治疗药物在中国的上市。据不完全统计,自临床急需境外上市药品目录发布至今,国家药监局已经批准了36个品种进口注册。
其中,今年上半年批准了9款,与2019年上半年批准数(6款)有所提升。从往年获批情况来看,下半年获批数量均在10个以上,预计2020年全年将会有更多临床急需境外新药在中国获批。
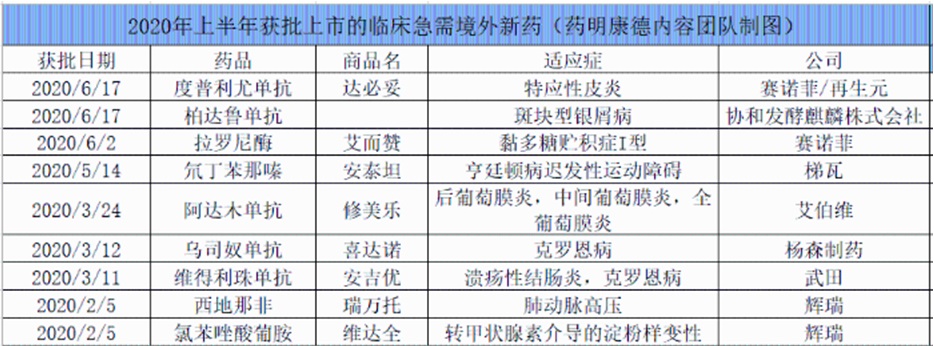
图3 注:数据截至2020年6月30日,以国家药监局批准日期为准
值得一提的是,辉瑞普强旗下枸橼酸西地那非片从2019年9月上市申请正式获CDE受理,2020年2月通过优先审评正式获批上市,历时仅4.5个月,成为在中国首个被批准用于治疗肺动脉高压的5型磷酸二酯酶(PDE-5)抑制剂。这是临床急需境外新药在中国获得加速批准的代表之一。
这些获批的临床急需境外新药中,有多款“首个”值得关注。其中,赛诺菲近日获批的重磅抗炎疗法度普利尤单抗注射液,是全球首个也是唯一获批治疗成人中重度特应性皮炎的靶向生物制剂;注射用拉罗尼酶浓溶液是全球首个也是目前唯一批准治疗黏多糖贮积症Ⅰ型(MPSⅠ)的酶替代疗法,同时也是中国唯一治疗MPSⅠ的特异性治疗药物。梯瓦公司(Teva)用于治疗与亨廷顿病(HD)有关的舞蹈病及成人迟发性运动障碍(TD)的创新药物氘代丁苯那嗪片,则是国家药监局和美国FDA批准的第一个氘代产品。
中国本土创新药企业,持续绽放光彩
在39款获批新药中,由中国本土创新企业带来的产品有9款,当中的7款为首次获批。包括百济神州的BTK抑制剂泽布替尼,北海康成HER2阳性乳腺癌药物奈拉替尼、豪森药业的非小细胞肺癌治疗药物阿美替尼,凯因科技的丙型肝炎药物盐酸可洛派韦胶囊,银谷制药的过敏性鼻炎药物苯环喹溴铵鼻喷雾剂,复星医药首个引进的血小板减少症新药阿伐曲泊帕,三生国健药业乳腺癌新药伊尼妥单抗等。其中,北海康成的奈拉替尼和复星医药的阿伐曲泊帕均为从海外引进的产品。
图4 注:数据截至2020年6月30日,以国家药监局批准日期为准
泽布替尼的获批备受关注。它于今年6月在中国通过优先审评审批程序附条件批准上市,首次获批两项适应证,包括套细胞淋巴瘤(MCL)和慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)。泽布替尼还是首个获得美国FDA授予“快速通道”“加速审评”“突破性疗法”和“优先审评”四大特殊通道资格认定的中国自主研发抗癌新药,去年11月率先在美国获批。
另外,凯因科技开发的中国国产1类新药盐酸可洛派韦胶囊是半年来为数不多被国家药监局宣布获批上市的创新药。它通过抑制NS5A蛋白而阻断HCV病毒的复制和组装,今年2月在中国获批用于成人慢性丙型肝炎病毒(HCV)感染。
希望这些新药的到来可以造福更多中国患者,同时也期待下半年迎来更多进展,有更多新药好药获批来到患者的身边,让科学的力量持续为患者健康带来积极的改变。
注:文中数据均为不完全统计。
