“金眼科、银外科”是医疗行业公开的秘密,这表明眼科这一细分领域具有巨大的市场价值。据报道,前几年火爆一时的莎普爱思,仅一个品种在2016年的销售额就超过7亿元,占其所在企业主营业务收入的70%左右。眼科用药市场容量如何?当前我国的市场格局究竟是怎样的?
小产品 大市场
随着仿制药质量和疗效一致性评价的深入开展,国内仿制药竞争愈加激烈;集采政策的陆续出台,将加速国内普通仿制药市场进入低利润时代;国家版辅助用药目录确立,DRG付费模式逐步启用,将促使医院用药结构重新洗牌。
面对医药产业的结构性变化,未来我国医药企业的转型出路主要有三条:一是专注高质优价的普通仿制药;二是聚焦小众领域、高端仿制药;三是开发有临床价值的创新药或改良型新药。
作为国内领先的药企,恒瑞医药曾于2019年宣布:从投入产出比的角度衡量,公司已停掉普通仿制药的研究项目,专注于创新药和有核心价值的高端仿制药。但其此后再度布局眼科领域,引进国际干眼症新药、首家申报他氟前列素仿制药,正是看中了眼科领域“小产品、大市场”的市场潜力。
近年来,随着我国人口老龄化发展、大众生活方式改变及电子产品的广泛使用,眼部疾病发病率显著上升,大众护眼意识也随之不断提高,眼科用药市场规模保持持续增长。
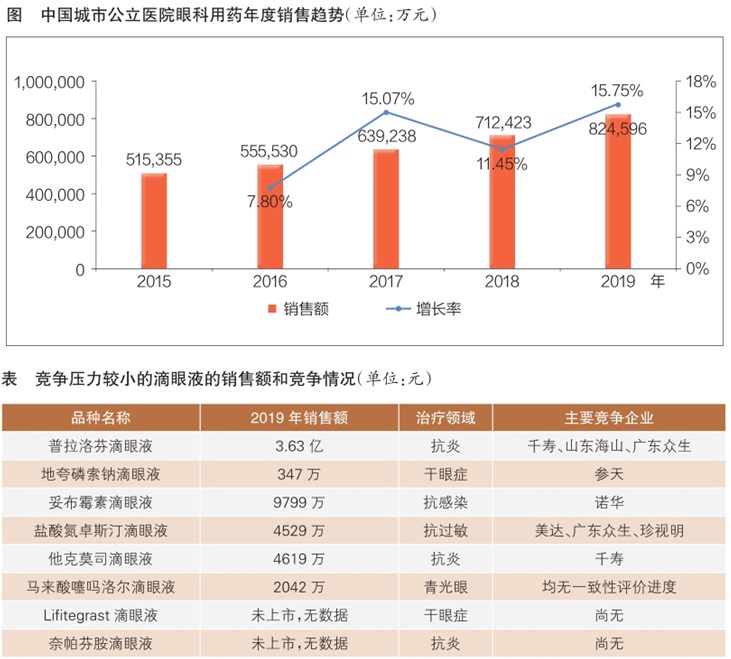
数据显示,2019年中国城市公立医院眼科用药销售额为82.46亿元,同比增长15.75%(见图),约占中国公立医疗机构眼科用药市场的75.44%。由此预估,2019年中国公立医疗机构终端眼科用药销售额约为109.30亿元。如果纳入实体药店和网络药店,国内眼科市场容量将会更大。由此可见,我国眼科用药市场正在不断扩容。
从小类格局来看,眼部血管病变治疗药物、干眼症用药、抗感染药物、抗炎药物占据主要市场地位。从剂型格局来看,眼科用药主要剂型分为眼用制剂、注射剂、凝胶剂、片剂、胶囊剂五大类。其中,眼科用药产品排名前十的全部属于眼用制剂和注射剂。
主要产品市场布局
目前,国内研发热度较高的滴眼液主要集中在干眼症、抗感染、抗炎、青光眼等领域。
研发热度最高的产品——玻璃酸钠滴眼液
玻璃酸钠滴眼液是国内临床使用最广泛的人工泪液,也是各种类型干眼症的基础用药之一,销售额排名第一。2019年,其单品城市公立医院销售额超过9亿元,由原研药参天和EUSAN占据主要市场。
基于其优异的市场表现,玻璃酸钠滴眼液已成为众多眼科用药生产企业重点关注的明星产品,竞争较为激烈。目前已有3个进口(含原研)产品和16个国产产品,其中2个为新4类获批。此外,还有中山万汉制药、扬子江药业、沈阳兴齐、山东海山等4家企业已提交上市申请,目前正处于审评审批状态。但对于实力强劲的国内企业,该领域仍有机会破局、重塑市场。
其他研发热度较高的产品
除玻璃酸钠滴眼液外,其他关注度较高的产品有聚乙烯醇、奥洛他定、莫西沙星、左氧氟沙星、曲伏前列素、拉坦前列素、他氟前列素和硫酸阿托品等。
其中,用于治疗干眼症的聚乙烯醇滴眼液,2019年销售额达1.79亿元,主要竞争的企业有信东生技、湖北远大天天明和中山万汉制药;抗过敏领域的治疗用药盐酸奥洛他定滴眼液,2019年销售额为1.74亿元,主要竞争企业有诺华、河北创健药业和齐鲁制药;抗炎领域的治疗用药溴芬酸钠滴眼液,2019年销售额为0.74亿元,主要竞争企业有辰欣佛都、千寿、齐鲁制药、四川禾亿和天津金耀等;抗感染领域治疗用药盐酸莫西沙星滴眼液和左氧氟沙星滴眼液,2019年销售额分别为125万元和5.26亿元;青光眼领域治疗用药曲伏前列素滴眼液、他氟前列素滴眼液及拉坦前列素滴眼液,2019年销售额分别为1.18亿元、1036万元及1.39亿元。
可关注的冷门产品
近年来,我国眼科用药市场中普拉洛芬、妥布霉素、马来酸噻吗洛尔滴眼液等老牌产品依然保持较高且稳步增长的销售趋势;地夸磷索钠、氮卓斯汀、他克莫司滴眼液等新产品已初显锋芒,正处于快速增长期;国际市场Lif itegr ast、奈帕芬胺滴眼液等产品也展现出强劲的增长动力和市场潜力。
企业开发冷门产品,可巧妙地避开市场的激烈竞争,并有望实现首家仿制上市或首家通过一致性评价,抢占市场先机。当前,普拉洛芬滴眼液、地夸磷索钠滴眼液、妥布霉素滴眼液等产品竞争压力较小,国内眼科用药生产企业可关注并尝试研发(见表)。
BE试验豁免的法规要求
眼用制剂通常采用局部给药的方式,一般不涉及全身性吸收。因此,已确立的用于评价口服固体制剂药物生物等效性(BE)的体内药动学研究方法不适用于眼用制剂。从当前情况来看,发挥局部作用的真溶液可以豁免BE研究,从而大大加快研发进度,降低研发费用。其他眼用制剂需要根据品种的不同情况进行具体分析。
FDA推荐的眼用制剂临床试验方案有三种。第一种是体外试验,即对局部起效的溶液型眼用制剂,如果其化学性质和制造过程都足以证明生物等效性,可通过体外试验给予体内生物等效性研究豁免。第二种是PK为终点的体内生物等效性试验,即部分品种通过检测眼局部靶组织的药物浓度,计算药动学参数,评价仿制制剂与参比制剂的等效性。第三种是临床终点生物等效性试验,即一些局部起效的眼用制剂,没有确定的药效学标志物,但具有可接受的临床终点指标或替代终点指标,只能采用临床终点生物等效性试验评价仿制制剂和参比制剂的等效性。
此外,眼科用药属于专科领域,一致性评价进度整体缓慢,竞争压力小,在DRG付费和一致性评价推进过程中,具有治疗价值的化药市场将进一步扩大,有望以高品质药品入围未来激烈的集采竞争。一致性评价可重点关注的项目有左氧氟沙星滴眼液、妥布霉素滴眼液和马来酸噻吗洛尔滴眼液;新4类可重点关注的项目有玻璃酸钠滴眼液、地夸磷索钠滴眼液、盐酸奥洛他定滴眼液、盐酸氮卓斯汀滴眼液及他克莫司滴眼液等;新3类可重点关注的项目有立他司特滴眼液、奈帕芬胺滴眼液和聚乙烯醇滴眼液等。(新领先供稿)
