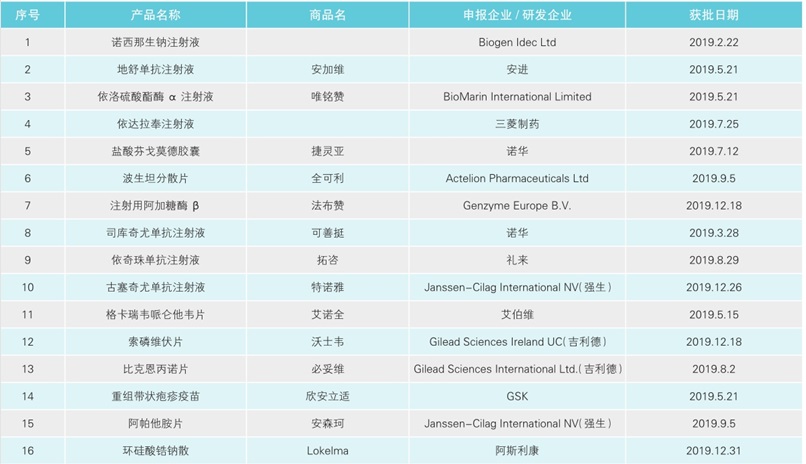
近年来,国家药监部门加大服务和指导力度,对近十年在美国、欧盟或日本已批准上市但尚未在我国上市的临床急需新药加速审评审批。2019年,国家药监局批准了16个临床急需境外新药的进口上市申请,涉及脊髓性肌萎缩症、骨巨细胞瘤、法布雷病等多个适应症。
(一)罕见病用药
目前,全球已知有超过7000种罕见病。由于发病率低、患者少、市场需求小、药物研发周期长、研发成本较高,长期以来国内罕见病药物研究进展缓慢。为满足国内罕见病患者的用药需求,国家药监部门加速罕见病用药的审评审批。2019年,获批的16个临床急需境外新药中有7个为罕见病用药。
1.脊髓性肌萎缩症——诺西那生钠注射液
申报企业:BiogenIdec Ltd
脊髓性肌萎缩症(SMA)是一种罕见的遗传性神经肌肉疾病,在新生儿中的发病率约为1/6000~1/10000。在诺西那生钠注射液上市之前,SMA无药可治,国内及世界范围内对SMA的治疗措施仅限于呼吸支持、营养支持、骨科矫形等辅助治疗方法。2016年12月23日,该药首次在美国获批,是全球首个SMA精准靶向治疗药物。该药通过鞘内注射给药,直接将药物输送到脊髓周围的脑脊液中,从而改善患者运动功能,提高生存率,改变SMA的疾病进程。
2019年2月22日,诺西那生钠注射液正式在中国获批,用于治疗5q型SMA,成为中国首个治疗SMA的药物。
2.骨巨细胞瘤——地舒单抗注射液(商品名:安加维)
申报企业:Amgen Inc.(安进)
骨巨细胞瘤是一种极为罕见且进展迅速、富含人核因子活化因子受体配体(RANKL)的原发性骨肿瘤。
在骨巨细胞瘤患者体内,地舒单抗对肿瘤基质成分所分泌的RANKL的抑制可显著减少或消除破骨细胞样肿瘤相关巨细胞。因此,骨质溶解减少,巨细胞肿瘤进展减慢,增生性基质被致密的非增生性、分化型编织新骨代替,最终改善临床结局。
地舒单抗注射液于2010年5月28日在欧盟获批上市;2019年5月21日,国家药监局有条件批准该药上市,用于骨巨细胞瘤不可手术切除或者手术切除可能导致严重功能障碍的成人和骨骼发育成熟的青少年患者治疗。同时要求申请人在该药获批后继续开展在我国的临床研究,制定并严格执行风险管理计划。
3.黏多糖贮积症ⅣA型——依洛硫酸酯酶α注射液(商品名:唯铭赞)
申报企业:BioMarin International Limited
黏多糖贮积症ⅣA型(MPS ⅣA)是一种极为罕见的遗传性溶酶体贮积症。患者最常见的特征是进行性骨骼发育不良、肌肉骨骼或呼吸功能障碍。该病会严重限制患者活动、耐力和呼吸功能,需要频繁手术治疗。
依洛硫酸酯酶α是目前全球范围内唯一批准治疗MPS ⅣA的药物,可靶向治疗其基础病因——N-乙酰半乳糖胺-6-硫酸酯酶(GALNS)缺乏,改善患者肺功能,并显著增加步行距离。
2018年,该药被列入首批临床急需境外新药名单,2019年5月21日获国家药监局批准上市,用于治疗MPS ⅣA患者。
4.肌萎缩侧索硬化症——依达拉奉注射液
申报企业:Mitsubishi Tanabe Pharma Corporation(三菱制药)
肌萎缩侧索硬化症(ALS)俗称“渐冻人症”,是由于运动神经细胞进行性退化,导致四肢、躯干、胸部、腹部的肌肉逐渐无力和萎缩,以及言语、吞咽和呼吸功能减退,直至呼吸衰竭死亡,病因至今不明。
依达拉奉是一款神经保护剂,能强效清理自由基,使神经免于氧化应激和神经元凋亡。依达拉奉最初于2001年在日本被批准用于治疗脑卒中;2015年6月,在日本获批用于治疗ALS,其后在韩国、美国、加拿大等国获批用于治疗ALS。
2019年7月25日,依达拉奉注射液在我国获批。临床研究显示,该药可以延缓ALS患者的身体机能下降速度。
5.多发性硬化症——盐酸芬戈莫德胶囊(商品名:捷灵亚)
申报企业:Novartis Pharma Schweiz AG(诺华)
多发性硬化症(MS)是一种严重的终身进行性、致残性的中枢神经系统脱髓鞘疾病,好发于20岁~40岁人群。全球有大约230万名患者,我国约有3万名。
芬戈莫德是一种新型免疫抑制剂,属于神经鞘氨醇1-磷酸受体调节剂,能促使淋巴细胞在淋巴结中滞留,达到抑制自身免疫反应的效果。2010年,盐酸芬戈莫德胶囊在美国获批上市;2019年7月12日,该药在我国正式获批用于治疗10岁或10岁以上患者的复发型多发性硬化。
6.儿童肺动脉高压——波生坦分散片(商品名:全可利)
申报企业:Actelion Pharmaceuticals Ltd
肺动脉高压是一种慢性、危及生命的疾病。患者的肺动脉压力显著升高,继而导致右心衰竭和严重的运动耐量下降,严重者会死亡。
波生坦分散片是一种口服有效的内皮素受体拮抗剂(ERA),于2001年上市。该药是获批的首个儿童肺动脉高压(PAH)治疗药物,目前已获全球多个国家批准。
2019年,该药被纳入第二批临床急需境外新药名单,是国内首个获批的儿童肺动脉高压用药,其上市可帮助改善患者预后、提高生活质量。
7.法布雷病——注射用阿加糖酶β(商品名:法布赞)
申报企业:Genzyme Europe B.V.
法布雷病是由X染色体连锁基因缺陷造成的一种先天性代谢疾病,始发于胎儿并伴随患者终身,逐步恶化,引起心、肾等重要器官衰竭。我国约有超过300名法布雷病确诊患者。2018年,法布雷病被收录于国家《第一批罕见病目录》,属严重危及生命且国内尚无有效治疗手段的疾病;2019年3月,注射用阿加糖酶β被列入第二批临床急需境外新药名单。
阿加糖酶β由赛诺菲子公司 Genzyme 研发,并于 2001 年在欧洲上市,于2003 年在美国上市,可帮助患者缓解疼痛、提高生活质量。2019年12月18日,注射用阿加糖酶β在我国获批上市,适用于8岁以上的儿童和青少年及成人法布雷病患者。
(二)皮肤疾病用药
银屑病是一种常见的慢性炎症性皮肤病,易反复。银屑病除了导致皮损外,还可合并关节病变、心血管疾病、代谢综合征等全身性病变,严重影响患者身心健康与生活质量。2019年,3个境外已上市银屑病治疗新药在我国获批上市。
8.司库奇尤单抗注射液(商品名:可善挺)
申报企业:Novartis Pharma Schweiz AG(诺华)
司库奇尤单抗是全球首个全人源白介素-17A(I L-17A)抑制剂,用于治疗符合系统治疗或光疗指征的中度至重度斑块型银屑病的成年患者。该药于2019年3月28日在我国获批,是第一批临床急需境外新药名单中首个获批的用于银屑病的生物制剂。
司库奇尤单抗将治疗靶点集中于IL-17A这一银屑病核心致病因子上,能特异性结合任何来源的IL-17A而不妨碍其他细胞因子正常工作。
9.依奇珠单抗注射液(商品名:拓咨)
申报企业:Eli Lilly and Company(礼来)
依奇珠单抗是一款靶向IL-17A抑制剂,以高亲和力特异性结合银屑病关键致病因子白介素17A(IL-17A/A和IL-17A/F)。该药于2019年8月29日获国家药监局批准上市,用于治疗适合系统治疗或光疗的中度至重度斑块型银屑病成人患者。
10.古塞奇尤单抗注射液(商品名:特诺雅)
申报企业:Janssen-Cilag International NV(强生)
该药是全球首个被批准用于银屑病治疗的抗人白细胞介素-23(IL-23)的单克隆抗体,通过阻断IL-23与细胞表面IL-23受体结合,破坏IL-23介导的信号传导、激活和细胞因子的级联反应,抑制IL-23生物活性,对斑块型银屑病发挥疗效。
该药品被列入第一批临床急需境外新药名单。2019年12月26日,国家药监局按照优先审评审批程序加快批准该品种的进口注册申请,用于适合系统性治疗的中重度斑块型银屑病成人患者。
(三)感染性疾病用药
11.格卡瑞韦哌仑他韦片(商品名:艾诺全)
申报企业:AbbVie Corporation(艾伯维)
2018年6月13日,格卡瑞韦哌仑他韦片凭借“与现有治疗手段相比具有明显治疗优势”获得国家药监局优先审评资格;2019年3月28日,该产品被列入第二批临床急需境外新药名单;2019年5月15日获批上市,用于治疗基因1、2、3、4、5、6型慢性丙型肝炎病毒(HCV)感染的无肝硬化或代偿期肝硬化成人患者。
我国约有1000万名丙肝患者。“艾诺全”的获批有望让我国广大丙肝患者受益。由于不通过肾脏代谢,该药适用于任何程度的肾功能损害患者(包括进行透析的患者)且无须调整给药剂量。
12.索磷维伏片(商品名:沃士韦)
申报企业:Gilead Sciences Ireland UC(吉利德)
索磷维伏片是由索磷布韦、维帕他韦和伏西瑞韦组成的固定剂量复方,于2017年获得美国FDA和欧盟EMA的批准;2019年12月18日,该药获国家药监局批准,用于治疗既往接受过含直接抗病毒药物(DAA)方案、无肝硬化或伴代偿性肝硬化的成人慢性丙型肝炎病毒(HCV)感染。作为治愈率高的泛基因型药物,索磷维伏片为需要新治疗方案的患者带来了希望。
13.比克恩丙诺片(商品名:必妥维)
申报企业:Gilead Sciences International Ltd.(吉利德)
该药用于治疗成人HIV-1感染,是吉利德公司研发的“比克替拉韦/恩曲他滨/丙酚替诺福韦”三合一复方剂型,于2018年2月7日获美国FDA批准上市,4个月后在欧盟获批。
2018年11月28日,该药在我国申报上市,并被纳入优先审评名单;2019年8月2日,该药在我国获批。
14.重组带状疱疹疫苗(商品名:欣安立适)
研发企业:GlaxoSmithKline Biologicals SA(GSK)
带状疱疹是一种由水痘-带状疱疹病毒引起的感染性疾病,通常表现为一种出现在身体单侧并伴随疼痛、瘙痒的皮疹,可持续两周至四周;常见并发症为带状疱疹后神经痛,疼痛可持续数月至数年,严重影响患者正常工作和生活。
重组带状疱疹疫苗采用DNA重组技术,2017年10月,重组带状疱疹疫苗在美国首先获批上市;2019年5月21日,国家药监局在充分论证安全性和有效性的前提下,有条件批准其进口注册申请,用于50岁及以上成人带状疱疹的预防;同时,针对本品虽境外已上市但缺乏国内全面流行病学数据,以及采用新佐剂是否会导致潜在免疫介导性疾病风险等问题,国家药监局要求申请人继续全面做好上市后研究,及时开展药物警戒、更新国内外临床安全性和有效性数据、完善说明书,充分保障患者用药安全、有效、风险可控。
(四)其他药品
15.阿帕他胺片(商品名:安森珂)
申报企业:Janssen-Cilag International NV(强生)
前列腺癌是我国男性泌尿生殖系统发病率最高的恶性肿瘤。
阿帕他胺片是新一代雄激素受体抑制剂,用于治疗有高危转移风险的非转移性去势抵抗性前列腺癌(NM-CRPC)成年患者。
该药是首个获得美国FDA批准用于NM-CRPC患者的新一代雄激素受体抑制剂,临床研究显示,其对前列腺特异性抗原(PSA)水平有显著控制作用。该药可阻断前列腺癌细胞中的雄激素信号通路,通过三种途径抑制癌细胞的生长,从而推迟远处转移发生时间。2019年3月,阿帕他胺片被纳入第二批临床急需境外新药名单,2019年9月5日获国家药监局批准上市。
16.环硅酸锆钠散(商品名:Lokelma)
申报企业:AstraZeneca(阿斯利康)
高钾血症是慢性肾病患者常见的并发症,若治疗不及时,可导致心律失常甚至猝死。目前,临床常用的治疗药物有帕替罗默山梨醇钙和聚苯乙烯磺酸钠/钙,但国内仅有聚苯乙烯磺酸钠/钙获批上市,临床需求未满足。
环硅酸锆钠散是一种高度选择性的口服除钾剂,分别于2018年3月和2018年5月获得欧盟、美国批准用于治疗高钾血症成人患者。2019年5月,该药被纳入第二批临床急需境外新药名单;2019年12月31日获国家药监局批准上市,用于治疗成人高钾血症。
