当前,国家组织的药品集中采购和使用试点扩围如火如荼。早在2018年12月落地的“4+7”带量采购试点中,中标的25个品种平均降价幅度达52%。值得注意的是,此次中标品种涉及的企业中,有20个企业(包括本厂、子公司、集团内或关联公司等)具备原料药(API)自产能力。随着试点扩围,“原料药+制剂”一体化企业的成本优势将得到集中体现。
仿制药市场增长带动特色原料药发展
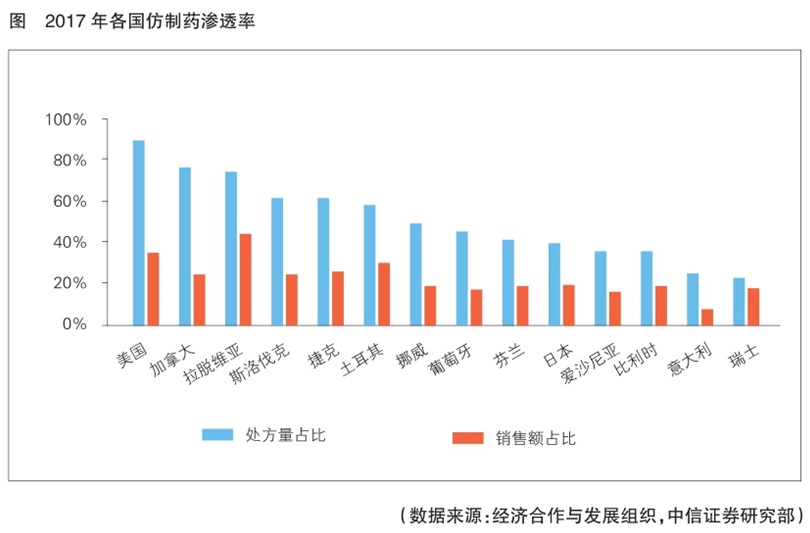
综观全球医药市场,随着人口老龄化不断加剧,各国政府医疗支出承压,使得全球范围内仿制药的处方量及销售规模占比明显提升。以美国为例,2017年,美国仿制药处方量占比已达到90%,而仿制药支出金额仅占37%(见图)。2008~2017年,美国仿制药替代创新药节省的费用达到1.79万亿美元。
专利悬崖也在刺激仿制药市场快速增长。据Eval uate Phar ma预测,2019~2024年,全球有可能受到专利悬崖威胁的药品销售额高达1980亿美元,考虑到仿制药价格约为专利药的10%~20%,预计未来5年,仿制药行业将迎来200亿美元~400亿美元的原研替代空间。这将大大刺激仿制药相关特色原料药的发展。
原料药行业低端产能出清优质企业受益
我国是原料药生产和出口大国。近几年,我国对环保的要求趋严,化学原料药及中间体制造企业受到严格监管,环保不达标的企业被责令整改甚至关停,原料药及制剂企业数量已经由2015年的超过5000家下降至2018年11月底的4441家。
与此同时,国家对新增原料药产能建设的审批更加严格。2017年,我国原料药企业新建产能首次出现下滑,引起沙坦、普利等多种原料药供应紧张及价格上行。考虑到环保、质量标准收紧将是长期趋势,预计优质原料药企业有望持续受益于原料药行业的供给侧出清。
系列政策推动原料药行业
回归质量和价值本源
2015年至今,我国药品审评审批政策发生深刻变化,更加注重产品的质量、有效性,以及临床数据的真实性,政策间协同共振,推动药品行业最终回归质量和价值本源。
仿制药质量和疗效一致性评价将仿制药以“同质化标准品”的维度评估,企业研发效率、生产成本逐渐成为竞争关键要素,不同品牌间的质量差异显著缩小;按通用名进行医保支付,使不同品牌产品间的支付金额趋同。我国仿制药行业已迎来去品牌化的长周期起点,预计创新药及国产优质仿制药将逐步替代原研药。
参照日本推行仿制药一致性评价的历史经验(20年间仿制药企业从1500家减少至约300家),预计我国大量此前主要依靠医院渠道把控、质量水平较低的仿制药将放弃一致性评价,仿制药行业集中度将不断提升。此外,随着仿制药进入通用名时代,原料药质量成为通过一致性评价的关键,部分制剂企业为了通过一致性评价甚至逐渐开始进口原料药,预计原料药企业在产业链中的地位将逐步提升。目前,我国通过仿制药一致性评价受理号较多的企业,多为具备原料药产能及产业链纵深优势的龙头企业,预计“原料药+制剂”一体化企业的 质量把控及供应链优势将愈发凸显。
带量采购推动成本优势企业以量换价
2018年底,国家医疗保障局牵头的药品集中带量采购试点,以政府GPO(药品采购组织)的模式实现药品降价采购,短期压缩了行业利润,长期有利于具备成本优势的优质企业脱颖而出。
长期以来,我国仿制药商业模式类同创新药。仿制药企业需要通过市场推广、铺货代理商渠道、政府招标、进院审核、带金销售等繁杂环节获取医院的销售份额,导致仿制药企业将大量资金用于销售环节。而在仿制药一致性评价叠加带量采购的政策驱动下,预计仿制药企业用于市场销售的费用将大幅缩减。行业定价权将逐渐从销售端转向生产端,制药企业的成本控制、技术难度、质量水平将取代渠道把控,成为竞争重点。由此可见,“原料药+制剂”一体化企业无疑更具有成本优势。
9月1日,上海阳光医药采购网发布了《联盟地区药品集中采购文件》,标志着国家组织药品集中采购和使用试点城市正式扩围至全国。此次试点扩围引进了“多家中标”新规,对于具有3家以上竞争企业的品种,竞争更为激烈。一方面,“以价换量”竞争使得成本把控成为企业核心竞争力;另一方面,根据报价相同时的规则,原料药自产、优先通过仿制药一致性评价的企业享有优先权。“原料药+制剂”一体化企业在成本及优先级上均享有优势,竞争力强劲。
原辅包关联审评审批后成本端行业洗牌趋势明显
原辅包关联审评审批,标志着我国原料药行业监管逐渐与国际DMF制度接轨,原料药供应商议价能力进一步提高。
2019年7月,国家药品监督管理发布的《关于进一步完善药品关联审评审批和监管工作有关事宜的公告》明确,自2019年8月15日起,药品制剂注册申请与已登记的原辅包进行关联。药品制剂注册申请人或药品上市许可持有人对药品质量承担主体责任,根据药品注册管理和上市后生产管理的有关要求,对原辅包供应商质量管理体系进行审计,保证符合药用要求。预计在关联审评审批制度下,原辅包和制剂企业的绑定将更加紧密,制剂企业为了降低原辅包的质量风险,更倾向选择与产品质量较高、供应稳定的原辅包企业合作。
关联审评审批制度的实施,将加速原料药行业低端产能出清,有望提升市场集中度。DMF制度下,制剂企业成为药品质量的主要负责人,对选用原料药的质量负责,因此在原料药的选择上将更加谨慎。此种情形下,同时具备原料药、制剂生产能力企业的优势会更加显现。(作者单位:中信证券)
