从全球来看,生物药市场占比呈现逐渐提升的趋势。2019年全球生物药市场规模为2928亿美元,预计2025年市场规模将达5445亿美元,期间复合增长率达到10.9%,相对整体医药市场增速继续维持快速增长。从国内来看,生物药市场具有强劲的增长潜力,2019年市场规模达3172亿元,随着未来可支付能力提高、医保覆盖范围增大、研发投入增加,生物药市场规模将进一步扩大。
笔者在此对2020年国家药监局药审中心(CDE)受理生物药注册及审批情况进行简要分析。
疫苗
2020年,CDE共受理159个疫苗申请(国内97个、进口62个),涵盖肺炎球菌、脑膜炎、流感病毒、狂犬疫苗以及近年比较热的人乳头瘤病毒(HPV)等多个领域,其中包括19个国产疫苗、4个进口疫苗的临床试验申请,7个国产疫苗的生产申请获得受理,无进口疫苗申请销售。
表1:2020年CDE受理和获批上市疫苗情况

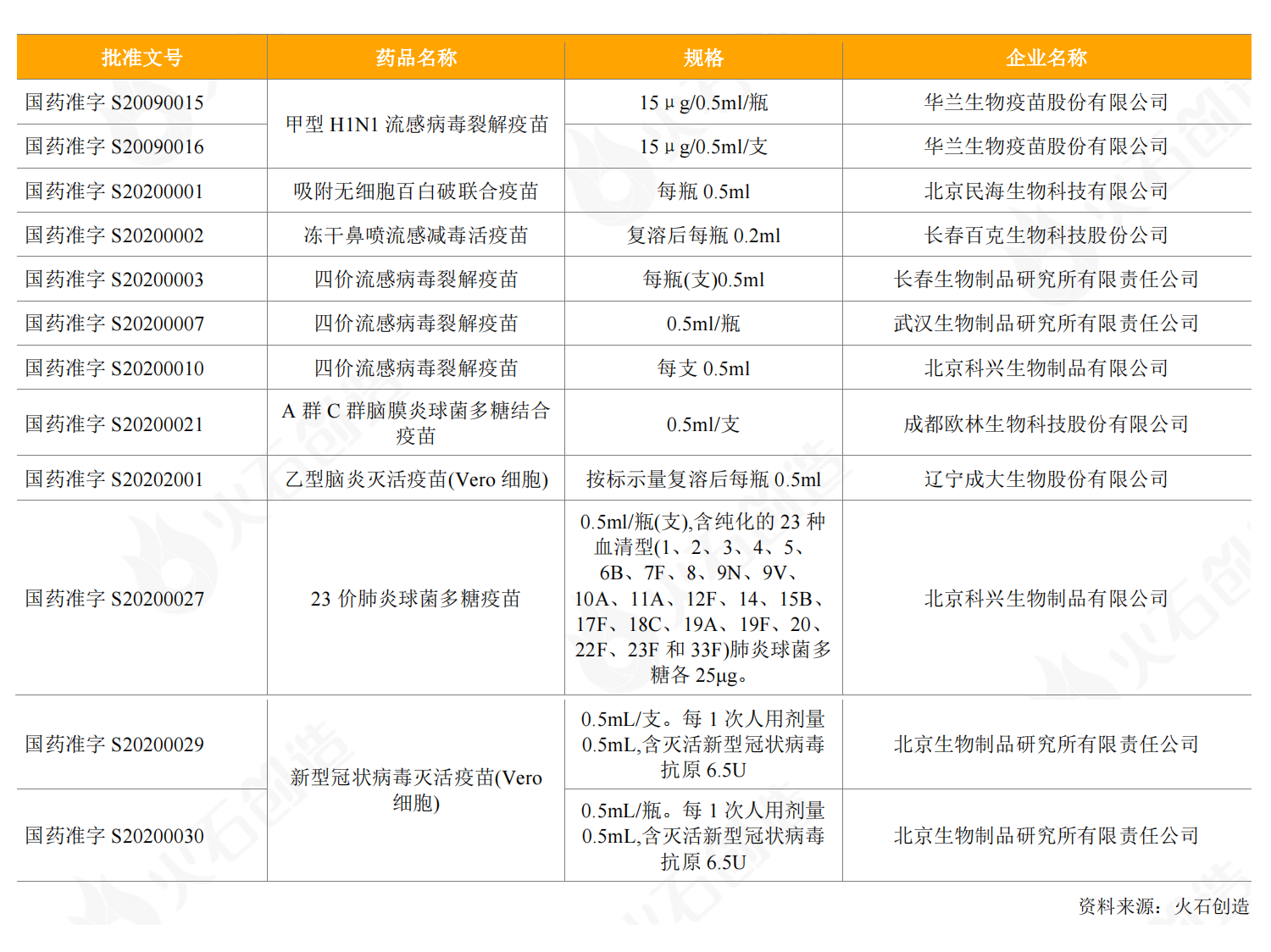
2020年,国内获批上市国产疫苗10种,共12个批件,涉及流感、百白破、脑炎等疫苗。其中,百克生物的冻干鼻喷流感减毒活疫苗是国内首款获批上市的采用鼻腔喷雾给药方式接种的流感疫苗,此前国内批准上市的流感疫苗均采用肌肉注射方式接种。
表2:2020年新获批上市的国产疫苗情况
新冠肺炎疫情的影响下,我国研发实力进一步凸显。早在疫情暴发初期,我国就布局了5条技术路线开展新冠病毒疫苗研究。2020年12月31日,国药集团中国生物新冠灭活疫苗已获得国家药监局批准附条件上市。
抗体药物
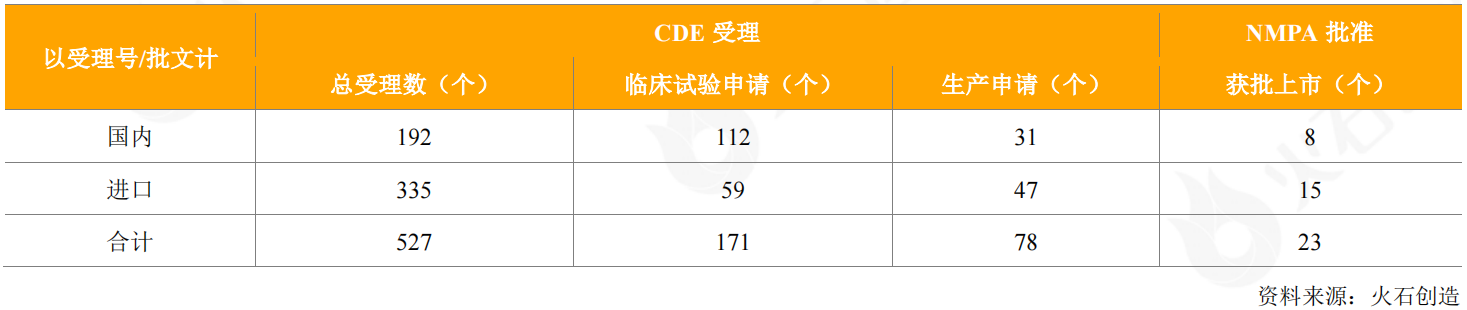
2020年,CDE共受理了527个抗体药物的申请(国内192个和进口335个),其中包括112个国产抗体药物、59个进口抗体药物的临床试验申请,以及31个国产抗体药物、47个进口抗体药物的生产(销售)申请。
表3:2020年CDE受理和获批上市抗体药物情况
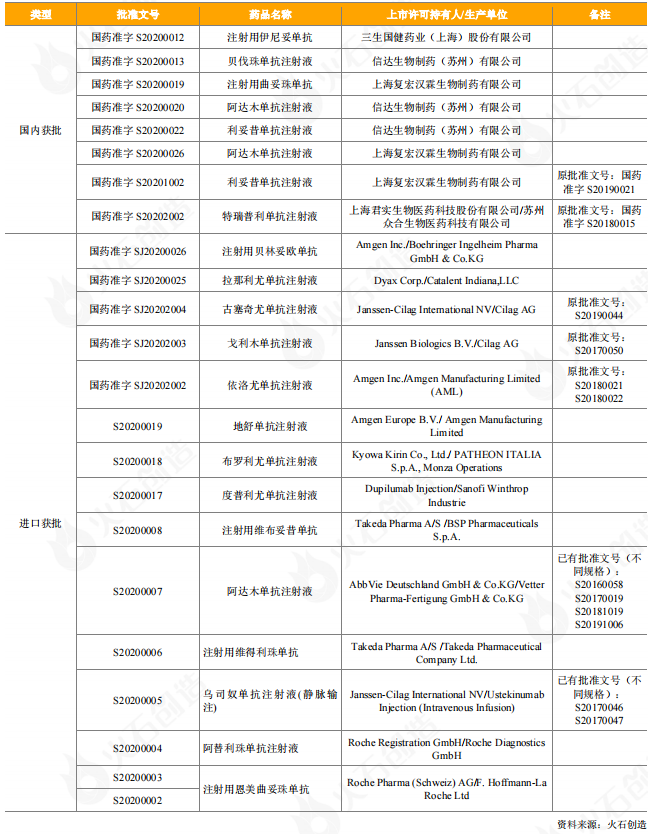
从获批上市的情况看,2020年有8个国产单抗药物获批上市,其中6个单抗药物为2020年首次获批上市,包括三生国健的2类新药伊尼妥单抗,信达生物的3款生物类似药贝伐珠单抗、阿达木单抗、利妥昔单抗,复宏汉霖的阿达木单抗、曲妥珠单抗。2020年有多个重磅进口药获批上市,在14个获批上市的进口单抗药物中(15个批件),有9个药物为2020年首次获批。百济神州引进的安进生物注射用贝林妥欧单抗获批上市,是全球首个且唯一的CD3-CD19双特异性抗体,用于治疗成人复发或难治性前体B细胞急性淋巴细胞白血病(ALL);安进生物的地舒单抗注射液,是中国首个、目前唯一一个用于骨质疏松症治疗的抗RANKL单抗类药物,可帮助绝经后妇女显著降低椎体、非椎体及髋部骨折的发生风险;武田中国旗下的注射用维布妥昔单抗是全球首个、也是目前唯一一个以CD30为靶点的抗体偶联药物,注射用维得利珠单抗是目前炎症性肠病(IBD)领域唯一的肠道选择性生物制剂;恩美曲妥珠单抗是由罗氏和ImmunoGen共同研发的抗HER2靶向药物曲妥珠单抗与抑制微管聚集的化疗药物美坦新(DM1)通过硫醚连接子连接而成的抗体偶联物(即ADC药物)。
表4:2020年获批上市抗体药物情况
从临床试验申请获得受理的情况来看,君实生物、恒瑞医药、百济神州、信达生物等国内企业表现突出。国外巨头罗氏、诺华、默沙东多款产品获得受理,如罗氏的PD-L1抗体阿替利珠单抗、默沙东的帕博利珠单抗注射液。
从上市申请获得受理的情况来看,君实生物的特瑞普利单抗注射液上市申请获得受理;勃林格殷格翰、葛兰素史克、罗氏等跨国企业的30个进口单抗药物(47个受理号)的上市申请获得受理。
重组蛋白
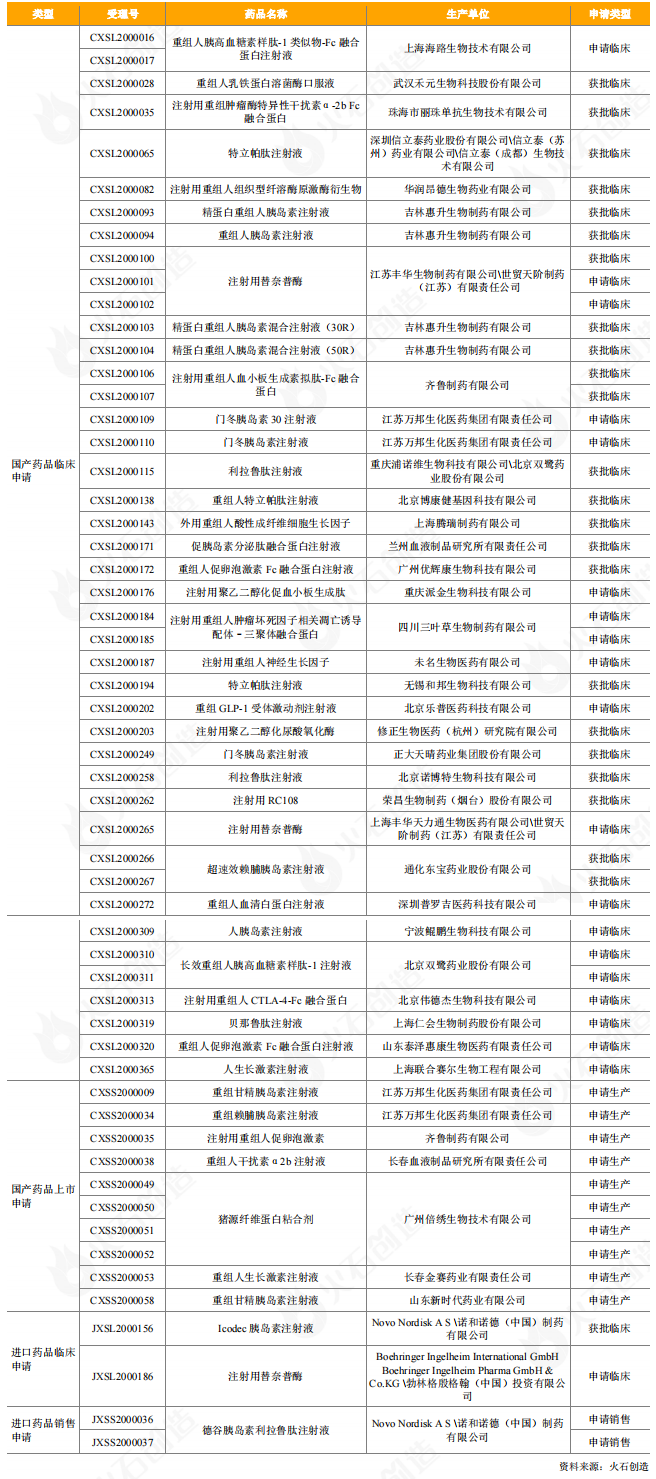
2020年,我国批准上市的重组蛋白产品共有5个。另外,截至2020年底,CDE共新增受理了87个重组蛋白药品的申请(国产61个,进口26个),国产重组蛋白批件中有43个药品申请临床试验,已有24个获得临床批件,10个药品申请上市,均处于审评审批阶段;进口重组蛋白批件中,2个为申请销售,尚未获批上市,另有2个申请临床,1个获得了临床批件。
表5:2020年CDE受理和获批上市重组蛋白产品情况
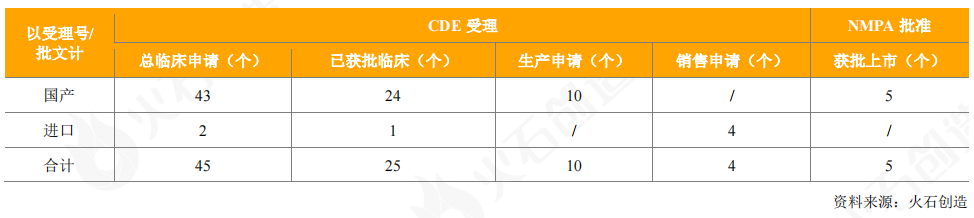
从获批上市的情况看,2020年共获批3个国产重组蛋白产品(5个批件),包括智飞龙科马1类新药重组结核杆菌融合蛋白(EC)3个品规,甘李药业的门冬胰岛素注射液和东阳光药的重组人胰岛素注射液。
表6:2020年新获批上市国产重组蛋白产品情况
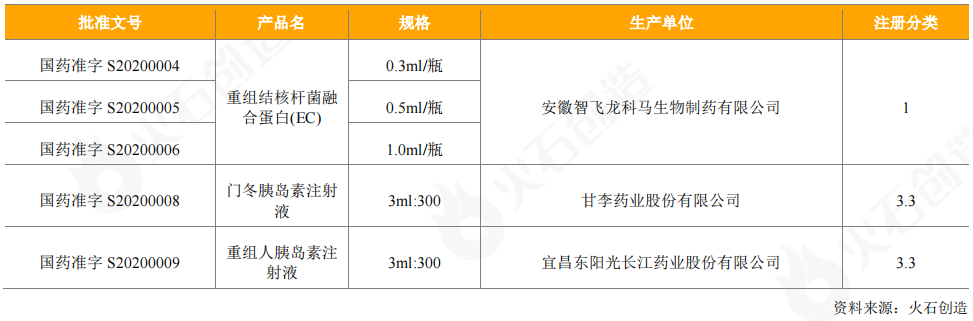
从申请获得受理的情况看,CDE共受理31个国产重组蛋白产品的临床试验申请,共计43个受理号,已发24个批件;2个进口药品申请临床试验,其中诺和诺德的Icodec胰岛素注射液已获批件,勃林格殷格翰的注射用替奈普酶在审评审批中。另外,CDE受理了7个国产重组蛋白产品的上市申请,共计10个受理号,均在审评审批中;1个进口产品的销售申请,2个受理号,即诺和诺德的德谷胰岛素利拉鲁肽注射液,产品尚在审评审批中。
表7:2020年CDE受理重组蛋白产品情况
血液制品
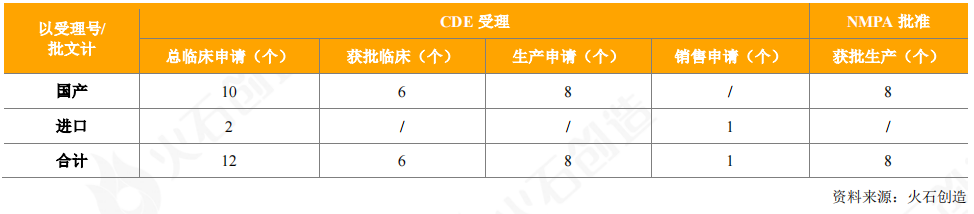
2020年,CDE共批准上市血液制品8个,注册分类均为3类;另外,CDE共受理了55个血液制品,有12个申请临床(3个获得临床批件),9个申请生产/销售(包括1个进口血液制品,人血白蛋白),目前处于审评审批阶段。
表8:2020年CDE受理和获批上市血液制品情况
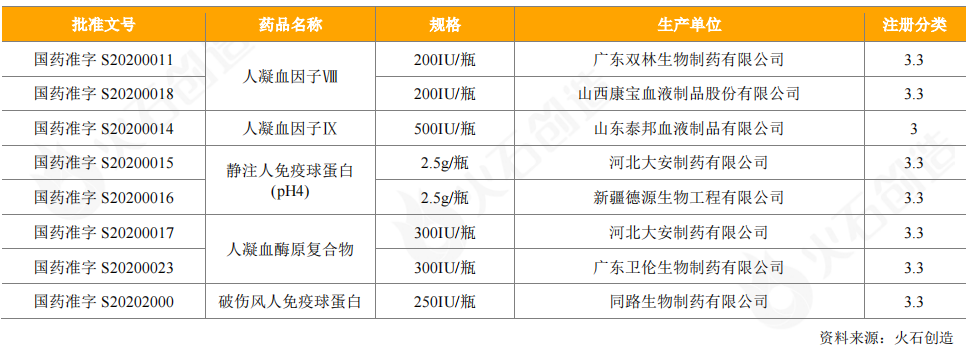
从获批上市的情况看,2020年获批上市血液制品5个,涉及8个批件,凝血因子类和免疫球蛋白类仍是血液制品获批主体。
表9:2020年新获批上市血液制品情况
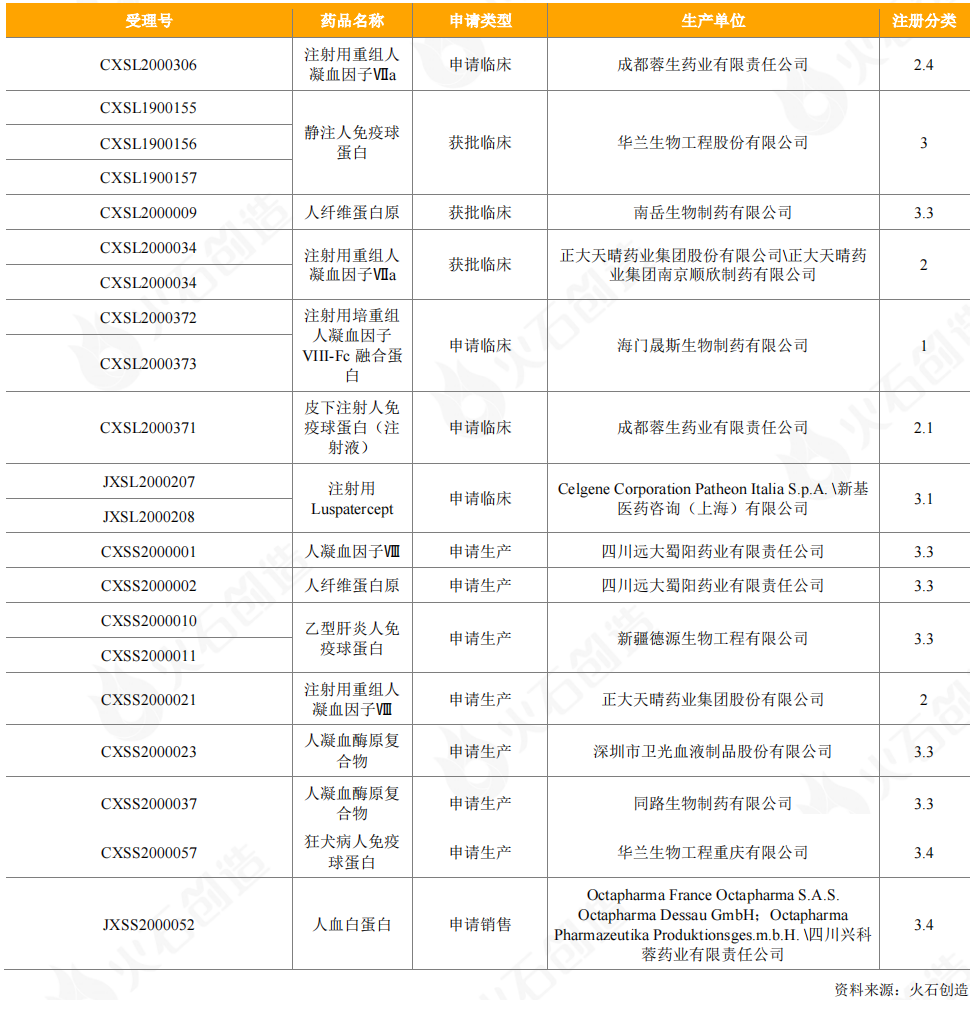
从受理情况来看,兴科蓉医药进口Octapharma人血白蛋白的申请获得受理,另有12个血液制品申请临床试验,8个血液制品申请生产,以免疫球蛋白类、凝血因子类为主。重组人凝血因子Ⅶa、Ⅶ以注册分类2类药获批临床或申请生产,申请厂家有正大天晴和成都蓉生;其余血液制品均以3类药进行注册;远大蜀阳药业的人凝血因子Ⅷ获得优先审评。
表10:2020年CDE受理血液制品情况
细胞和基因治疗
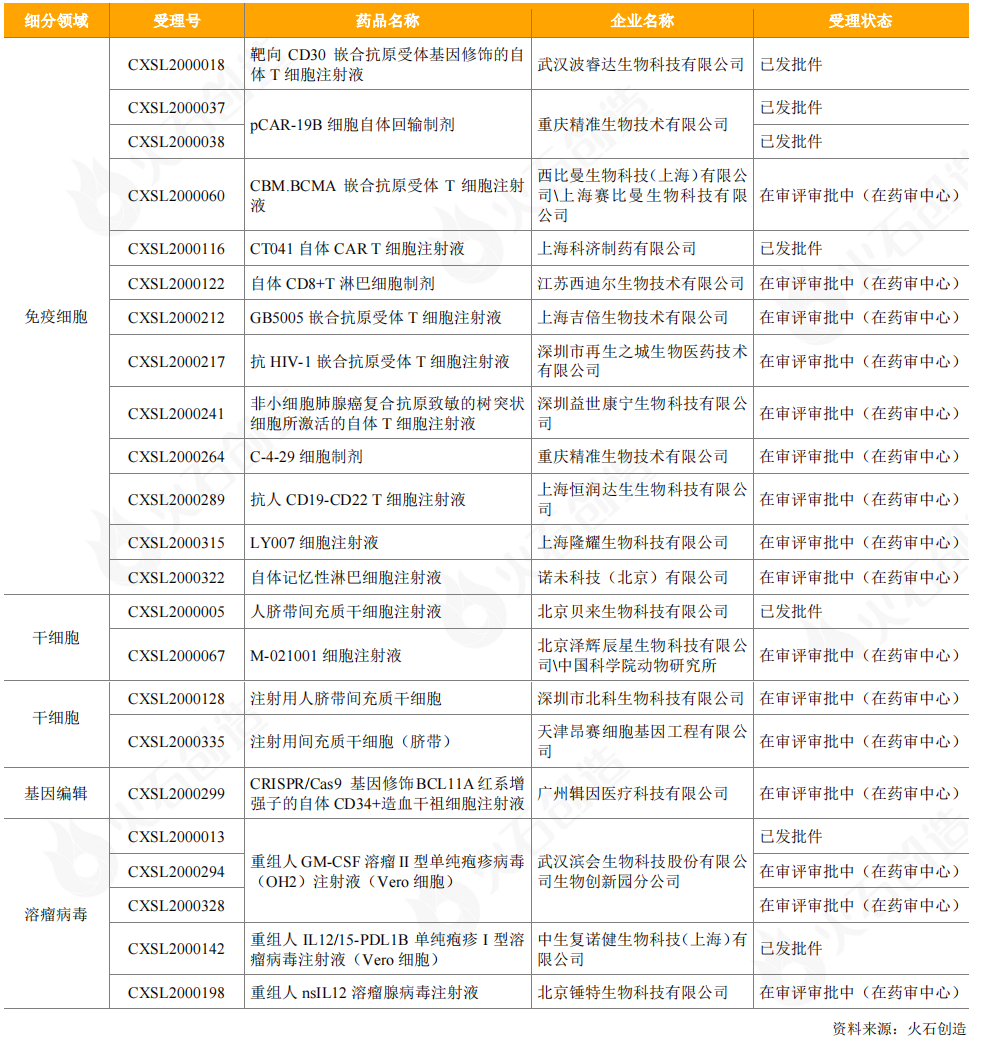
2020年,国内CAR-T细胞疗法产品接连提交上市申报。2020年2月26日,国内首个CAR-T细胞治疗产品上市申请获CDE受理,即复星凯特从KitePharma引进的抗人CD19CAR-T细胞治疗产品益基利仑赛注射液(暂定);2020年6月30日,瑞基仑赛注射液(暂定)成为国内第2款申报上市的CAR-T疗法,该产品是在美国Juno公司JCAR017基础上,由药明巨诺自主开发的靶向CD19的CAR-T疗法。两款CAR-T细胞疗法产品均纳入优先审评。
从临床试验申请来看,2020年CDE受理了1个进口细胞治疗药品,为天士力从全球领先干细胞研发公司Mesoblast引进的异体人骨髓间充质前体细胞产品。CDE受理的20个国产细胞和基因治疗产品中,有免疫细胞产品12个,包括西迪尔生物的CTL细胞疗法、隆耀生物的CTL细胞疗法、益世康宁的ACTL细胞疗法、诺未科技的NewishT自体记忆性淋巴细胞,以及恒润达生(双靶点)、波睿达生物(双靶点)、重庆精准生物、再生之城、吉倍生物、科济制药、西比曼生物/赛比曼生物的CAR-T细胞产品;有干细胞产品4个,包括1个人胚胎干细胞产品和3个间充质干细胞产品;有基因治疗产品4个,包括1个CRISPR/Cas9基因编辑疗法产品和3个溶瘤病毒产品。
表11:2020年CDE受理的国产细胞和基因治疗产品临床试验申请情况