为进一步指导和规范真实世界证据用于支持药物研发和审评的有关工作,2020年1月7日,国家药监局正式发布《真实世界证据支持药物研发与审评的指导原则(试行)》(以下简称指导原则)。指导原则指出,对于某些缺乏有效治疗措施的罕见病和危及生命的重大疾病领域,传统随机对照试验难以实施,因此,在药物研发和监管领域如何利用真实世界证据评价药物的有效性和安全性,已成为全球相关监管机构、制药工业界和学术界共同关注且具有挑战性的问题。这说明,罕见病治疗领域将成为真实世界证据应用的重点领域之一。
真实世界证据VS随机对照试验
真实世界证据(RWE)是指通过对适用的真实世界数据(RWD)进行恰当和充分的分析所获得的关于药物的使用情况和潜在获益-风险的临床证据,包括通过对回顾性或前瞻性观察性研究或者实用临床试验等干预性研究获得的证据。其中,真实世界数据是指来源于日常所收集的各种与患者健康状况和/或诊疗及保健有关的数据。真实世界数据的常见来源主要包括:卫生信息系统、医保系统、疾病登记系统、前瞻性研究设计等。
对于随机对照试验(RCT)与真实世界证据(RWE),国外曾有专家提出要使用RWE来替代RCT,以减少药品的高额研发成本和风险较大的罕见不良反应。今年2月发表在《新英格兰医学杂志》的题为《RCT的魔力与RWE的神话》的文章指出,RCT和RWE二者各有利弊:RCT成本高,不容易发现风险较大的罕见不良反应;而RWE存在固有的潜在偏倚,容易产生错误的结局指标。目前,大多数官方机构指南中都倾向于将RWE运用于罕见病药物、抗肿瘤药物等高度创新药物领域,而并非所有的药物研发领域。笔者在此主要从罕见病药物审批上市及罕见病药物医保准入两个方面,探讨RWE在罕见病药物领域的应用。
国外真实世界证据支持罕见病药物审批情况
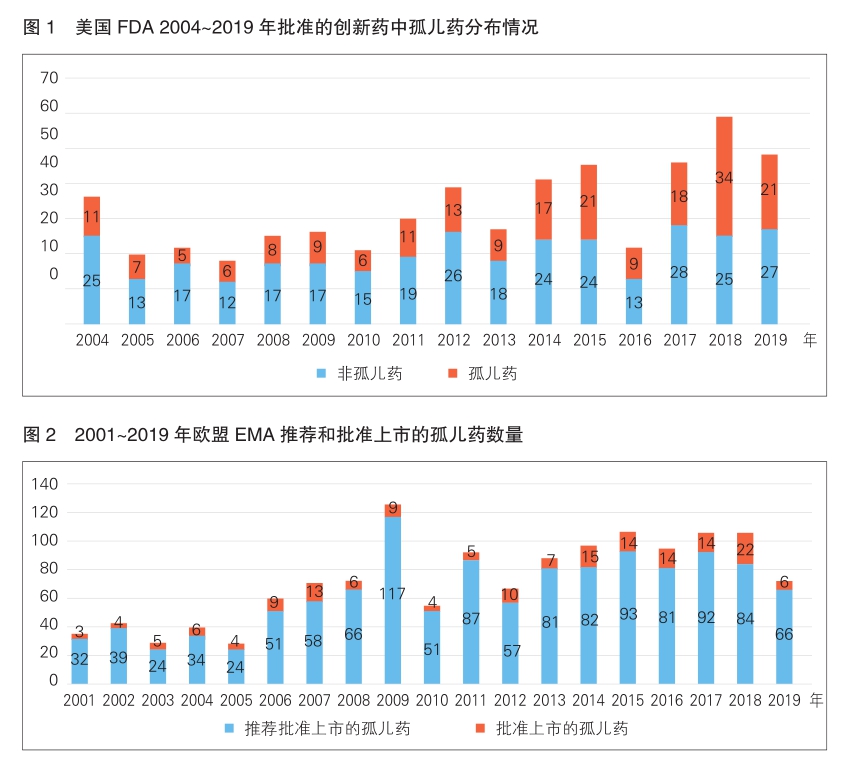
美国 美国是全球首个通过关于罕见病用药法案的国家。美国FDA近几年批准的罕见病用药的数量占创新药的比重一直较高,美国各大药物研发机构对罕见病用药的研发也是热情高涨。
FDA最早收集和使用真实世界证据用于监管决策,可追溯至2009年美国的“前哨行动”(Sentinel Init iative)。2016年12月,美国国会通过《21世纪治愈法案》,鼓励FDA开展真实世界研究并使用真实世界证据支持药物及其他医疗产品的新适应证批准和上市后研究。自2016年起,FDA在充分考虑真实世界证据的基础上,至少批准了9个罕见病治疗新药的上市申请。
欧盟 1999年12月,欧盟通过了欧洲第一个罕见病法案,并成立了罕见病药物管理委员会,专门负责制定罕见病药物的激励政策。截至2019年底,欧盟罕见病药物管理委员会已批准160余种罕见病用药。
欧盟药品管理局(EMA)于2013年参与的Get Real 倡议项目,致力于开发出收集真实世界证据的新方法,以便尽早用于药物研发和医疗保健决策。2014年,EMA启动适应性许可试点项目(Adaptive Licensing Pil ot),探索利用真实世界证据进行药品评审的可行性。
项目运行之初,EMA认为,真实世界证据在罕见病药物审批中主要起到临床试验补充证据作用,用于支持药物安全性决策。随着真实世界证据的广泛应用,EMA开始考虑将真实世界证据用于支持罕见病药物的有效性研究。例如,2015年,EMA批准Al exion公司使用真实世界证据进行Eculizumab药物扩大适应证的申请。
探索以真实世界证据支持罕见病药物纳入医保
真实世界证据在医药领域的另一项重要应用在于支持医保准入决策。目前,国外真实世界证据主要通过为卫生技术评估(HTA)提供补充材料以支持罕见病药物纳入医保的决策。
由于罕见病患者数量少,罕见病药物的需求迫切以及罕见病相关疾病负担数据的难获得性,造成RCT往往难以在罕见病群体中实施,因此多个国家的HTA机构在罕见病药物纳入医保决策中,将RWE当成重要的补充材料进行考虑。例如,英国国家卫生与临床优化研究所(NICE)在其HTA官方指南中,明确指出优先考虑RCT证据,但针对罕见病等特殊疾病,可使用RWE进行补充。一项研究显示,在NICE2012~2017年的HTA报告中,约5%使用了RWE作为证据材料,在所有含RWE的HTA报告中,13%为罕见病药物,并且近几年含RWE的HTA报告数量在不断增加。在使用方面,RWE被用于支持药物有效性和安全性,分别占44%和17%。除英国外,在法国、荷兰等国家,RWE也被广泛用于罕见病药物的HTA。
2017年8月,NICE发布Asf otase al f a(用于治疗罕见病小儿发作性低磷酸血症)的HTA指南。在评估中,NICE接受了两项疾病自然史研究,用这两项研究的历史对照数据支持Asf ot ase al fa的单臂试验。同时,NICE还接受了一项观察性研究和一项患者调查性研究,这两项研究分别提供了Asf ot ase al f a的生物活性数据和患者的生存质量数据,为药物的经济学评价建模提供了有效的人口统计学参数及疾病相关参数。
我国真实世界证据用于罕见病药物领域的进展及思考
目前,我国系统性开展使用真实世界证据支持药物评审和药物纳入医保的工作尚处于起步阶段。尽管如此,国内研究机构和学者对此高度关注,尤其是针对罕见病药物和抗肿瘤药物等高度创新的药物领域。
我国药品监管部门也在不断探索将真实世界证据纳入药物审评审批。2018年10月,国家药监局药审中心基于三家医院患者数据的回顾性研究获得的真实世界证据,扩大了贝伐珠单抗(用于治疗转移性癌症,包括罕见病脑胶质瘤)的适应证。相关真实世界研究还提供了血管内皮生长因子突变和脑转移等不同患者亚组中的疗效数据,从多角度证实了贝伐珠单抗联合疗法的有效性和安全性。
2019年5月,国家药监局药审中心发布的《真实世界证据支持药物研发的基本考虑(征求意见稿)》指出,罕见病治疗药物临床试验可以自然疾病队列形成的真实世界数据及相应真实世界证据作为外部对照。再到今年1月指导原则正式发布,我国已开始将真实世界证据纳入国家政策制定的衡量指标,支持将真实世界研究结果纳入罕见病药物等创新药物的监管决策。
虽然真实世界证据可以提高罕见病诊断率,缩短罕见病用药的审批和纳入医保时间,但笔者认为,在应用真实世界证据方面仍需要注意以下几点:一是目前发达国家运用真实世界证据评估罕见病用药主要还是在药品安全性方面,在有效性上则谨慎使用,药品的批准上市和医保决策依旧是以RCT为金标准,RWE为补充;二是真实世界证据是否科学合理,取决于数据质量,这对我国的医疗电子信息系统的完善和真实世界证据相关研究人才的培养提出较高要求;三是真实世界数据的公开透明性和对患者隐私权的保护需要有一个明确的界限和方案;四是使用真实世界证据进行药物监管决策所涉及的伦理问题,需要相关部门重点考虑。(作者单位:大连医科大学公共卫生学院;北京大学中国卫生发展研究中心)
