经过十多年的发展,SMO(Site Management Or ganization临床试验现场管理组织)产业在我国已逐步走出一条独具特色的发展路径。截至目前,我国已有近50家全国性、50家地区性SMO。但与发达国家和地区的SMO行业相比,我国SMO行业的市场集中度还比较低,从业人员整体偏年轻化,临床试验项目CRC(临床研究助理/临床研究协调员)的配备率及服务水平还有待提升。
欧美、日本等CRC/SMO已具备完整规范的行业体系
在欧美、日本等发达国家和地区,CRC作为临床试验的参与者和一种职业,已有30多年的发展历史。CRC是指经主要研究者授权,在临床试验中协助研究者进行非医学判断相关事务性工作的一种职业,其是临床试验的参与者和协调者,研究者、申办方和研究中心之间的重要纽带,也是加快临床试验进程、保证试验质量的重要力量。CRC的主要来源包括现场管理组织提供、机构聘用、主要研究者聘用、申办者或合同研究组织提供、行业协会提供等方式。
SMO是协助研究者在研究中心完成临床研究具体操作的一种合同研究组织。在美国,丰富的临床试验项目及全面的管理规范,使SMO行业十分繁荣,这种第三方机构广泛渗透到美国有条件开展临床研究的公立医院、私人医院和诊所中,一些具有一定规模的SMO企业通常还具有自身的临床研究中心。
欧美国家和地区的SMO通常分为两种:一种是SMO公司自身拥有一家或多家私人医院或诊所,并拥有相应的员工,如医生、护士和CRC等,这类公司有丹麦的西斯比亚和美国的Accel evance等;另一种类似于中介组织,也称为Invest igative Site Net work,如美国的SCRI,这类公司负责组织多家医院或者诊所的医生,将他们分派到各地的研究中心和研究团队去参与临床试验,主要职能为商务拓展、项目管理、质量控制、培训等。
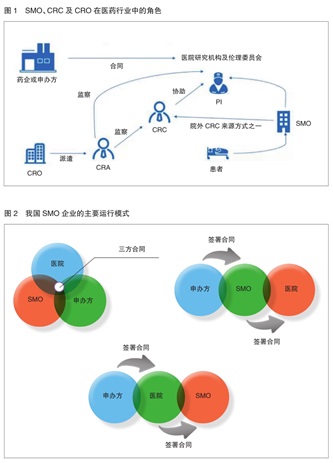
在国外,由于CRC与CRA(临床研究监察员)的职责及立场不同,临床CRO(合同研发组织)与SMO有着清晰的界限。CRO主要是派遣CRA对临床试验全过程进行组织管理,督促检查研究者的临床试验工作,以保证临床试验按方案和药物临床试验质量管理规范(GCP)执行(见图1)。
随着ICH-GCP的实施,各医院及研究机构对临床试验的伦理、科学、效率与过程规范程度等方面的要求逐渐提高,医疗机构内部部门与设施的复杂性则对临床试验的全程协调程度提出了更高要求。因此,在临床试验中,专门从事协调工作的CRC应运而生。
我国SMO行业以外派CRC到临床研究中心为主要业务模式
不同于国外SMO的发展路径,我国因临床资源紧缺等原因,SMO企业与临床CRO的界限较为模糊,且SMO多不具备临床研究中心,主要负责外派CRC到研究中心协助PI(主要研究者,即通常所说的项目负责人)开展临床试验的组织工作。
20世纪90年代末,我国少数开展临床试验比较活跃的医院开始出现临床研究助理,他们大多为退休护士,承担CRC工作,但并没有类似于SMO的企业参与到新药临床试验中。直到2008年,国内公司开始模仿国外的SMO开展部分业务,组建了以人力派遣为主的CRC团队参与临床试验,并在报价、管理、培训等商业模式上搭建了沿用至今的中国SMO的基本框架。
在随后的几年时间里,艾昆纬、泰格、润东、药明康德、博诺威、亿灵等CRO都各自成立了SMO部门,其临床试验项目主要来源于跨国制药企业,尤其是MRCT(国际多中心药物临床试验)。2015年7月,国家药监部门开展药物临床试验数据自查核查以后,国外及国内制药企业开展的新药临床试验均开始聘用CRC。由于CRC的需求量在短期内迅速增加,对SMO的管理形成较大的挑战。2015年之后,我国SMO的管理逐步走向规范化、规模化,CRC的聘用和管理成为临床试验过程中不可缺少的一个重要环节。
随着国内SMO行业的快速发展,许多独立的SMO企业相继成立,或者是原临床CRO内的SMO部门相继独立出来,成为一个单独运行的载体。
目前,我国SMO企业的运行模式主要分为三种:第一种是申办方与医院、SMO签署三方合同, SMO提供CRC到医院协助研究者完成临床研究项目;第二种是由申办方与SMO公司签署合同,委托SMO公司完成指定医院的临床研究项目,SMO公司与医院签署合同,提供CRC到医院协助研究者完成相应的临床项目;第三种是由申办方与医院签署合同,医院与SMO公司签署合同,SMO提供CRC到医院协助研究者完成临床研究项目(见图2)。
我国SMO行业尚存较大成长空间
据不完全统计,截至目前,我国SMO企业或以SMO业务为主营业务的全国性企业有47家,其中23家为具有临床CRO类型母公司的SMO,14家为具有SMO业务部门的临床CRO企业,10家为专业SMO公司。此外,全国还有大约50家只负责本地区研究机构临床试验的SMO企业。
目前,国内市场上主要有5家外资企业设立的SMO子公司,但因与国外的临床环境差别较大,这些外资企业难以复制其在国外已发展成熟的业务模式,使得这些公司的规模偏小。自2011年,由艾昆纬设立的昆拓信诚,在有效结合其国际领先优势与我国现状的基础上,在中国市场迅速扎根,公司规模不断扩大。
我国SMO市场集中度还比较低(目前暂无明晰确切的具体市场份额占比),而SMO是一类人力密集型的企业,主要产能瓶颈在于CRC员工的数量。据公开信息,截至目前,药明康德子公司上海津石、普蕊斯、泰格医药子公司思默医药科技、康龙化成战略合作伙伴联斯达等公司拥有专业CRC人员均已达到千人级别,还有一些规模在百人以上、正处于快速发展阶段的SMO企业,如CCBR子公司北京西斯比亚、诺思格子公司圣兰格、方恩子公司南京方腾、润东医药子公司首嘉医学、博济医药子公司砝码斯及海金格子公司北京奕华等。
国内SMO行业主要由一群具有专业背景但资历尚浅的年轻团队构成。“ 中国CRC之家”分别于2015年、2017年对33家成员单位进行了调研。调研结果显示,2015~2017年,国内CRC人数从316人激增至2334人,其中女性占比达94.8%,男性占比仅为5.2%;30岁以下占比为86.7%,30岁以上占比为13.3%;本科以上学历人数占比为82.5%。从工作年限来看,具备3~5年工作经验的人员占比仅为19.4%,1年以下工作经验的CRC占比则高达47.5%。
据公开信息,美国CRC人数为3万~10万人(年份不详);但我国直至2017年,CRC人数仅为6781人。2010~2018年,美国开展的临床试验数由6950项提升至8967项,年复合增长率为3.24%;我国开展的临床试验数已由619项提升至2026项,年复合增长率达到15.98%。假设2018年美国CRC人数为6.5万人,每个临床试验项目CRC人数为7.2488。SMO行业产能主要在于CRC人员的配备,以美国CRC人员配备标准——每个临床试验项目CRC人数为7.2488来计算,2018年我国CRC人数应达到14686人,远超过2017年我国登记在案的CRC人数。由此可见,国内CRC人才缺口较大。
2018年,我国将临床试验管理由审批制改为默示许可制。此后,国内临床研究项目数量快速增加。如何更好地利用和分配现有的医院资源和研究管理执行资源,将是今后整个行业需要着重考虑及解决的问题。未来,国内SMO行业必须在保障人才质量的同时,培养大量CRC,以解决专业人才短缺问题。同时,临床试验项目质量管理要求的提高,将加速国内SMO数字智慧化信息建设的步伐。不同于以往的SMO发展路径,未来国内SMO企业将回归全球市场上的传统路径,具备资金和人员实力的大型SMO企业将逐步独立建设临床研究中心,以此来保障企业的长期稳定发展。
[作者单位:凯盛融英信息科技(上海)股份有限公司]
